На цьому уроці ви дізнаєтеся про закономірності зміни електронегативності елементів в групі і періоді. На ньому ви розглянете, від чого залежить електронний торгівельний хімічних елементів. На прикладі елементів другого періоду вивчіть закономірності зміни електронегативності елемента.
Тема: Хімічна зв'язок. Електролітична дисоціація
Урок: Закономірності змін електронегативності хімічних елементів в групі і періоді
Закономірності змін значень відносної електронегативності в періоді
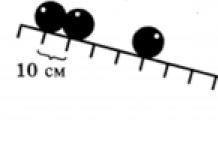
Розглянемо на прикладі елементів другого періоду, закономірності змін значень їх відносної електронегативності. Рис.1.
Мал. 1. Закономірності змін значень електронегативності елементів 2 періоду
Відносна електронегативність хімічного елемента залежить від заряду ядра і від радіусу атома. У другому періодізнаходяться елементи: Li, Be, B, C, N, O, F, Ne. Від літію до фтору збільшується заряд ядра і кількість зовнішніх електронів. число електронних шарів залишається незмінним.Значить, сила тяжіння зовнішніх електронів до ядра буде зростати, і атом буде як би стискуватися. Радіус атома від літію до фтору буде зменшуватися. Чим менше радіус атома, тим сильніше зовнішні електрони притягуються до ядра, а значить більше значення відносної електронегативності.
У періоді зі збільшенням заряду ядра радіус атома зменшується, а значення відносної електронегативності збільшується.

Мал. 2. Закономірності змін значень електронегативності елементів VII-A групи.
Закономірності змін значень відносної електронегативності в головних підгрупах
Розглянемо закономірності змін значень відносної електронегативності в головних підгрупах на прикладі елементів VII-A групи. Рис.2. У сьомій групі головній підгрупі розташовані галогени: F, Cl, Br, I, At. На зовнішньому електронному шарі у цих елементів однакове число електронів - 7. Із зростанням заряду ядра атома при переході від періоду до періоду, збільшується число електронних шарів, а значить, збільшується атомний радіус. Чим менше радіус атома, тим більше значення електронегативності.
У головній підгрупі зі збільшенням заряду ядра атома радіус атома збільшується, а значення відносної електронегативності зменшується.
Так як хімічний елемент фтор розташований в правому верхньому куті періодичної системи Д. І. Менделєєва його значення відносної електронегативності буде максимальним і чисельно рівним 4.
висновок:Відносна електронегативність збільшується зі зменшенням радіусу атома.
У періодах зі збільшенням заряду ядра атома електронегативність збільшується.
У головних підгрупах зі збільшенням заряду ядра атома відносна електронегативність хімічного елемента зменшується. Найбільш електронегативний хімічний елемент - це фтор, так як він розташований в правому верхньому куті періодичної системи Д. І. Менделєєва.
Підбиття підсумку уроку
На цьому уроці ви дізналися про закономірності зміни електронегативності елементів в групі і періоді. На ньому ви розглянули, від чого залежить електронний торгівельний хімічних елементів. На прикладі елементів другого періоду вивчили закономірності зміни електронегативності елемента.
1. Рудзитис Г.Є. Неорганічна і органічна хімія. 8 клас: підручник для загальноосвітніх установ: базовий рівень / Г. Е. Рудзитис, Ф.Г. Фельдман. М .: Просвещение. 2011 г.176с.: Ил.
2. Попель П.П.Хімія: 8 кл .: Підручник для загальноосвітніх навчальних закладів / П.П. Попель, Л.С.Крівля. -К .: ВЦ «Академія», 2008.-240 с .: іл.
3. Габрієлян О.С. Хімія. 9 клас. Підручник. Видавництво: Дрофа.: 2001. 224с.
1. №№ 1,2,5 (с.145) Рудзитис Г.Є. Неорганічна і органічна хімія. 8 клас: підручник для загальноосвітніх установ: базовий рівень / Г. Е. Рудзитис, Ф.Г. Фельдман. М .: Просвещение. 2011 г.176с.: Ил.
2. Наведіть приклади речовин з ковалентним неполярной зв'язком і іонної. Яке значення має електронний торгівельний в освіті таких з'єднань?
3. Розташуйте в ряд по зростанню електронегативності елементи другої групи головної підгрупи.
На цьому уроці ви дізнаєтеся про закономірності зміни електронегативності елементів в групі і періоді. На ньому ви розглянете, від чого залежить електронний торгівельний хімічних елементів. На прикладі елементів другого періоду вивчіть закономірності зміни електронегативності елемента.
Тема: Хімічна зв'язок. Електролітична дисоціація
Урок: Закономірності змін електронегативності хімічних елементів в групі і періоді
1. Закономірності змін значень електронегативності в періоді
Закономірності змін значень відносної електронегативності в періоді
Розглянемо на прикладі елементів другого періоду, закономірності змін значень їх відносної електронегативності. Рис.1.
Мал. 1. Закономірності змін значень електронегативності елементів 2 періоду
Відносна електронегативність хімічного елемента залежить від заряду ядра і від радіусу атома. У другому періоді знаходяться елементи: Li, Be, B, C, N, O, F, Ne. Від літію до фтору збільшується заряд ядра і кількість зовнішніх електронів. Число електронних шарів залишається незмінним. Значить, сила тяжіння зовнішніх електронів до ядра буде зростати, і атом буде як би стискуватися. Радіус атома від літію до фтору буде зменшуватися. Чим менше радіус атома, тим сильніше зовнішні електрони притягуються до ядра, а значить більше значення відносної електронегативності.
У періоді зі збільшенням заряду ядра радіус атома зменшується, а значення відносної електронегативності збільшується.

Мал. 2. Закономірності змін значень електронегативності елементів VII-A групи.
2. Закономірності змін значень електронегативності в групі
Закономірності змін значень відносної електронегативності в головних підгрупах
Розглянемо закономірності змін значень відносної електронегативності в головних підгрупах на прикладі елементів VII-A групи. Рис.2. У сьомій групі головній підгрупі розташовані галогени: F, Cl, Br, I, At. На зовнішньому електронному шарі у цих елементів однакове число електронів - 7. Із зростанням заряду ядра атома при переході від періоду до періоду, збільшується число електронних шарів, а значить, збільшується атомний радіус. Чим менше радіус атома, тим більше значення електронегативності.
У головній підгрупі зі збільшенням заряду ядра атома радіус атома збільшується, а значення відносної електронегативності зменшується.
Так як хімічний елемент фтор розташований в правому верхньому куті періодичної системи Д. І.Менделеева його значення відносної електронегативності буде максимальним і чисельно рівним 4.
висновок:Відносна електронегативність збільшується зі зменшенням радіусу атома.
У періодах зі збільшенням заряду ядра атома електронегативність збільшується.
У головних підгрупах зі збільшенням заряду ядра атома відносна електронегативність хімічного елемента зменшується. Найбільш електронегативний хімічний елемент - це фтор, так як він розташований в правому верхньому куті періодичної системи Д. І.Менделеева.
Підбиття підсумку уроку
На цьому уроці ви дізналися про закономірності зміни електронегативності елементів в групі і періоді. На ньому ви розглянули, від чого залежить електронний торгівельний хімічних елементів. На прикладі елементів другого періоду вивчили закономірності зміни електронегативності елемента.
1. Рудзитис Г. Е. Неорганическая і органічна хімія. 8 клас: підручник для загальноосвітніх установ: базовий рівень / Г. Е. Рудзитис, Ф. Г. Фельдман. М .: Просвещение. 2011 г.176с.: Ил.
2. Попель П. П.Хімія: 8 кл .: Підручник для загальноосвітніх навчальних закладів / П. П. Попель, Л. С.Крівля. - К .: ВЦ «Академія», 2008.-240 с .: іл.
3. Габрієлян О. С. Хімія. 9 клас. Підручник. Видавництво: Дрофа.: 2001. 224с.
1. Chemport. ru.
1. №№ 1,2,5 (с.145) Рудзитис Г. Е. Неорганическая і органічна хімія. 8 клас: підручник для загальноосвітніх установ: базовий рівень / Г. Е. Рудзитис, Ф. Г. Фельдман. М .: Просвещение. 2011 г.176с.: Ил.
2. Наведіть приклади речовин з ковалентним неполярной зв'язком і іонної. Яке значення має електронний торгівельний в освіті таких з'єднань?
3. Розташуйте в ряд по зростанню електронегативності елементи другої групи головної підгрупи.
Періодична система хімічних елементів Д. І. Менделєєва - це класифікація хімічних елементів у вигляді таблиці, в якій чітко видно залежність різних властивостей елементів від заряду атомного ядра. Дана система є графічним відображенням періодичного закону, встановленого російським хіміком Д. І. Менделєєвим в 1869 році. Створена була в 1869-1871 роках їм же. Таблиця складається з стовпців (групи) і рядків (періоди). Групи визначають основні фізико-хімічні властивості елементів в зв'язку з однаковими електронними конфігураціями на зовнішніх електронних оболонках. У періодах хімічні елементи збудовані також у певному порядку: зростає заряду ядра, і заповнюється електронами зовнішня електронна оболонка. Хоч для груп та характерні більш суттєві тенденції та закономірності, але є області, де горизонтальний напрямок більш значуще і показово, ніж вертикальне. Це відноситься до блоку лантаноїдів і актиноїдів.
Поняття про електронегативність
Електронегативність є основоположним хімічним властивістю атома. Цим терміном позначають відносну здатність атомів в молекулі відтягувати до себе загальні електронні пари. Електронегативність визначає тип і властивості хімічного зв'язку, і таким чином впливає на характер взаємодії між атомами в хімічних реакціях. Найвища ступінь електронегативності у галогенів і сильних окислювачів (F, O, N, Cl), а низька - у активних металів (I група). Сучасне поняття ввів американський хімік Л. Полінг. Теоретичне ж визначення електронегативності запропонував американський фізик Р. Маллікен.
Електронегативність хімічних елементів у періодичній системі Д. І. Менделєєва збільшується уздовж періоду зліва направо, а в групах - від низу до верху. Електронегативність залежить від:
- атомного радіусу;
- кількості електронів і електронних оболонок;
- енергії іонізації.
Так, в напрямку зліва направо радіус атомів зазвичай скорочується в зв'язку з тим, що у кожного наступного елемента збільшується кількість заряджених частинок, тому електрони притягуються сильніше і ближче до ядра. Це веде до збільшення енергії іонізації, так як сильна зв'язок в атомі вимагає більшої енергії на вилучення електрона. Відповідно, збільшується і електронний торгівельний.
При взаємодії елементів утворюються електронні пари за рахунок прийняття або віддачі електронів. Здатність атома відтягувати електрони була названа Лайнусом Полингом електронегативні хімічних елементів. Полінг склав шкалу електронегативності елементів від 0,7 до 4.
Що таке електронний торгівельний?
Електронегативність (ЕО) - кількісна характеристика елемента, що показує, з якою силою притягуються електрони ядром атома. ЕО також характеризує здатність утримувати валентні електрони на зовнішньому енергетичному рівні.

Мал. 1. Будова атома.
Можливість віддавати або приймати електрони визначає приналежність елементів до металів або неметалів. Яскраво вираженими металевими властивостями володіють елементи, легко віддають електрони. Елементи, які беруть електрони проявляють неметалічні властивості.
Електронегативність проявляється в хімічних сполуках і показує зміщення електронів в сторону одного з елементів.
Електронегативність збільшується зліва направо і зменшується зверху вниз в періодичній таблиці Менделєєва.
Як визначити
Визначити значення можна за допомогою таблиці електронегативності хімічних елементів або шкали Полінга. За одиницю прийнята електронний торгівельний літію.
Найбільшою ЕО мають окислювачі і галогени. Значення їх електронегативності більше двох. Рекордсменом є фтор з електронегативні 4.

Мал. 2. Таблиця електронегативності.
Найменшу ЕО (менше двох) мають метали першої групи періодичної таблиці. Активними металами вважаються натрій, літій, калій, тому що їм легше розлучитися з єдиним валентним електроном, ніж прийняти відсутні електрони.
Деякі елементи займають проміжне положення. Їх електронний торгівельний близька до двох. Такі елементи (Si, B, As, Ge, Te) виявляють металеві та неметалеві властивості.
Для зручності порівняння ЕО використовується ряд електронегативності елементів. Зліва розташовуються метали, праворуч - неметали. Чим ближче до країв, тим активніше елемент. Самий сильним відновником, легко віддають електрони і мають найменший електронний торгівельний, є цезій. Активним окислювачем, здатним притягувати електрони, є фтор.

Мал. 3. Ряд електронегативності.
У неметалічних сполуках притягують електрони елементи з більшою ЕО. Кисень з електронегативні 3,5 притягує атоми вуглецю і сірки з електронегативні 2,5.
Що ми дізналися?
Електронегативність показує ступінь утримання ядром атома валентних електронів. Залежно від значення ЕО елементи здатні віддавати або приймати електрони. Елементи з більшою електронегативність відтягують електрони і виявляють неметалічні властивості. Елементи, атоми яких легко віддають електрони, мають металеві властивості. Деякі елементи мають умовно нейтральну ЕО (близько двох) і можуть проявляти металеві та неметалеві властивості. Ступінь ЕО збільшується зліва направо і знизу вгору в таблиці Менделєєва.
Тест по темі
оцінка доповіді
Середня оцінка: 4.7. Всього отримано оцінок: 64.