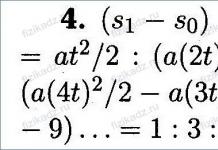баланс азоту азотисте рівновагу.
Решта амінокислоти легко синтезуються в клітинах і називаються замінними. До них відносять гліцин, аспарагінову кислоту, аспарагін, глутамінової кислоти, глутамін, серії, пролін, аланін.
Однак безбілкову харчування закінчується загибеллю організму. Виняток навіть однієї незамінної амінокислоти з раціону веде до неповного засвоєння інших амінокислот і супроводжується розвитком негативного азотистого балансу, виснаженням, зупинкою росту і порушеннями функцій нервової системи.
При безбілкової дієті на добу виділяється 4гр азоту, що становить 25гр білка (коеф-Т зношування).
Фізіологічний білковий мінімум-мінімальна кількість білків в їжі необхідне для підтримки азотистого рівноваги- 30-50 г / сут.
Перетравлюванні білків В шлунково-кишкового тракту. ХАРАКТЕРИСТИКА пептідази шлунка, ОСВІТА І РОЛЬ СОЛЯНОЇ КИСЛОТИ.
У харчових продуктах вміст вільних амінокислот дуже мало. Переважна їх кількість входить до складу білків, які гідролізуються в шлунково-кишковому тракті під дією ферментів протеаз). Субстратна специфічність цих ферментів полягає в тому, що кожен з них з найбільшою швидкістю розщеплює пептидні зв'язки, утворені певними амінокислотами. Протеази, гідролізуючі пептидні зв'язки всередині білкової молекули, відносять до групи ендопептідаз. Ферменти, які відносяться до групи екзопептідази, гидролизуют пептидний зв'язок, утворену кінцевими амінокислотами. Під дією всіх протеаз шлунково-кишкового тракту білки їжі розпадаються на окремі амінокислоти, які потім надходять в клітини тканин.
Освіта і роль соляної кислоти
Основна травна функція шлунка полягає в тому, що в ньому починається переварювання білка. Істотну роль в цьому процесі відіграє соляна кислота. Білки, що надходять в шлунок, стимулюють виділення гістаміну і групи білкових гормонів - гастрину , Які, в свою чергу, викликають секрецію НСІ і профермента - пепсиногену. НСI утворюється в обкладальних клітинах шлункових залоз
Джерелом Н + є Н 2 СО 3, яка утворюється в обкладальних клітинах шлунка з СО 2, диффундирующего з крові, і Н 2 О під дією ферменту карбоангідрази
Дисоціація Н 2 СО 3 призводить до утворення бікарбонату, який за участю спеціальних білків виділяється в плазму. Іони С1 - надходять в просвіт шлунка через хлорідний канал.
рН знижується до 1,0-2,0.
Під дією НСl відбувається денатурація білків їжі, що не зазнали термічній обробці, що збільшує доступність пептидних зв'язків для протеаз. НСl має бактерицидну дію і перешкоджає попаданню патогенних бактерій в кишечник. Крім того, соляна кислота активує пепсиноген і створює оптимум рН для дії пепсину.
Пепсиноген - білок, що складається з одного поліпептидного ланцюга. Під дією НСl він перетворюється в активний пепсин В процесі активації в результаті часткового протеолізу від N-кінця молекули пепсиногена отщепляются амінокислотних залишку, які містять майже всі позитивно заряджені амінокислоти, наявні в пепсіногенов. Таким чином, в активність пепсину переважаючими виявляються негативно заряджені амінокислоти, які беруть участь в конформаційних перебудовах молекули і формуванні активного центру. Утворилися під дією НСl активні молекули пепсину швидко активують інші молекули пепсиногена (аутокаталіз). Пепсин в першу чергу гидролизует пептидні зв'язку в білках, утворені ароматичними амінокислотами (фенілаланін, триптофан, тирозин) пепсин - ендопептідаза, тому в результаті його дії в шлунку утворюються коротші пептиди, але не вільні амінокислоти.
У дітей грудного віку в шлунку знаходиться фермент реннін (Химозин), що викликає згортання молока. У шлунку дорослих людей реннін немає, молоко у них створаживается під дією НСl і пепсину.
ще одна протеаза - гастриксин. Всі 3 ферменту (пепсин, реннін і гастриксин) подібні за первинну структуру
Кетогенная І глікогену Амінокислоти. АНАПЛЕРОТІЧЕСКІЕ РЕАКЦІЇ, СИНТЕЗ замінних амінокислот (ПРИКЛАД).
Катаболізм амінок-т зводиться до утворення піруват, ацетил-КоА, α -кетоглутарат, сукцинил-КоА, фумарат, оксалоацетат глікогенних амінокислоти - перетворюються в піруват і проміжні продукти ЦТК і утворюють в кінцевому підсумку оксалоацетат, можуть використовуватися впроцессе глюконеогенезу.
кетогенніамінок-ти в процесі катаболізму перетворюються в ацетоацетат (Ліз, Лей) або ацетил-КоА (Лей) і можуть використовуватися в синтезі кетонових тел.
глікокетогеннимі амінокислоти використовується і для синтезу глюкози, і для синтезу кетонових тіл, так як в процесі їх катаболізму утворюються 2 продукту - певний метаболіт цитратного циклу і ацетоацетат (Три, Фен, Тир) або ацетил-КоА (Ілі).
Анаплеротіческіе реакції - безазотистих залишки амінокислот використовуються для заповнення тієї кількості метаболітів загального шляху катаболізму, який витрачається на синтез біологічно активних речовин.
Фермент піруваткарбоксілази (кофермент - біотин), що каталізує цю реакцію, виявлений в печінці і м'язах.
2. Амінокислоти → Глутамат → α-кетоглутаратом
під дією глутаматдегідрогенази або амінотрансфераз.
3. 
Пропіоніл-КоА, а потім і сукцинил-КоА можуть утворитися також при розпаді вищих жирних кислот з непарним числом атомів вуглецю
4. Амінокислоти → Фумарат
5. Амінокислоти → оксалоацетата
Реакції 2, 3 відбуваються у всіх тканинах (крім печінки і м'язів), де відсутня піруваткарбоксілази.
VII. БІОСИНТЕЗ замінних амінокислот
В організмі людини може бути синтез восьми замінних амінокислот: Ала, Асп, АСН, Сер, Гли, Гли, Глн, Про. Вуглецевий скелет цих амінокислот утворюється з глюкози. α-Аміногрупа вводиться у відповідні α-кетокислот в результаті реакцій трансамінування. універсальним донором α -аминогруппами служить глутамат.
Шляхом трансаминирования α-кетокислот, що утворюються з глюкози, синтезуються амінокислоти
глутамат також утворюється при відновлювальному амінування α-кетоглутарата глутаматдегідрогеназа.

Трансамінування: СХЕМА ПРОЦЕСУ, ФЕРМЕНТИ, БІОРОЛЬ. БІОРОЛЬ АлАТ І АСАТ І КЛІНІЧНЕ ЗНАЧЕННЯ ЇХ ВИЗНАЧЕННЯ У СИРОВАТЦІ КРОВІ.
Трансамінування - реакція переносу α-аміногрупи з ак-и на α-кетокислот, в результаті чого утворюються нова кетокислоту і нова ак. процес трансамінування легко звернемо
Реакції каталізують ферменти амінотрансферази, коферментом яких служить пиридоксальфосфат (ПФ)
Амінотрансферази виявлені як в цитоплазмі, так і в мітохондріях клітин еукаріот. У клітинах людини знайдено понад 10 амінотрансфераз, що відрізняються за субстратної специфічності. Вступати в реакції трансамінування можуть майже всі амінокислоти, за винятком лізину, треоніну і проліну.

- На першій стадії до пиридоксальфосфатом в активному центрі ферменту за допомогою альдімінной зв'язку приєднується аминогруппа від першого субстрату - ак-и. Утворюються комплекс фермент-пірідоксіла-мінфосфат і кетокислот - перший продукт реакції. Цей процес включає проміжне утворення 2 шіффово підстав.
- На другій стадії комплекс фермент-пірідоксамінфосфат з'єднується з кетокислот і через проміжне утворення 2 шіффово підстав передає аміногрупу на кетокислоту. В результаті фермент повертається в свою нативну форму, і утворюється нова амінокислота - другий продукт реакції. Якщо альдегидная група пиридоксальфосфата не зайнята аминогруппой субстрату, то вона утворює шіффово підставу з ε-аміногрупою радикала лізину в активному центрі ферменту
Найчастіше в реакціях трансамінування беруть участь амінокислоти, зміст яких в тканинах значно вище за інших - глутамат, аланін, аспартаті відповідні їм кетокислот - α -кетоглутарат, піруват і оксалоацетат.Основним донором аміногрупи служить глутамат.

Найбільш поширеними ферментами в більшості тканин ссавців є: АЛТ (АлАТ) каталізує реакцію трансу-мінування між аланином і α-кетоглутаратом. Локалізована цей фермент в цитоплазмі клітин багатьох органів, але найбільша його кількість виявлено в клітинах печінки і серцевого м'яза. ACT (АСТ) каталізує реакцію трансами-вання між аепартатом і α-кетоглутаратом. утворюються оксалоацетат і глутамат. Найбільша його кількість виявлено в клітинах серцевого м'яза і печінки. органоспецифичность цих ферментів.
У нормі в крові активність цих ферментів становить 5-40 Е / л. При пошкодженні клітин відповідного органу ферменти виходять в кров, де активність їх різко підвищується. Оскільки ACT і АЛТ найбільш активні в клітинах печінки, серця і скелетних м'язів, їх використовують для діагностики хвороб цих органів. У клітинах серцевого м'яза кількість ACT значно перевищує кількість АЛТ, а в печінці - навпаки. Тому особливо інформативно одночасне вимірювання активності обох ферментів в сироватці крові. Співвідношення активностей ACT / АЛТ називають "Коефіцієнт де Рітіса".У нормі цей коефіцієнт дорівнює 1,33 ± 0,42. При інфаркті міокарда активність ACT в крові збільшується в 8-10 разів, а АЛТ - в 2,0 рази.
При гепатитах активність АЛТ в сироватці крові збільшується в ~8-10 раз, a ACT - в 2-4 рази.
Синтез меланіну.

види меланінів
Реакція активація метіоніну
Активною формою метіоніну є S-аденозилметионин (SAM) - сульфоніевая форма амінокислоти, що утворюється в результаті приєднання метіоніну до молекули аденозину. Аденозин утворюється при гідролізі АТФ.
Цю реакцію каталізує фермент метіонін аденозілтрансфераза, присутній у всіх типах клітин. Структура (-S + -CH 3) в SAM - нестабільна угрупування, що визначає високу активність метильної групи (звідси термін "активний метіонін"). Ця реакція унікальна для біологічних систем, так як, по-видимому, є єдиною відомою реакцією, в результаті якої звільняються всі три фосфатних залишку АТФ. Відщеплення метильної групи від SAM і перенесення її на з'єднання-акцептор каталізують ферменти метилтрансферази. SAM під час реакції перетворюється в S-аденозілгомоцістеін (SAT).

синтез креатину
Креатин необхідний для утворення в м'язах високоенергетичного з'єднання - кре-атінфосфата. Синтез креатину йде в 2 стадії за участю 3 амінокислот: аргініну, гліцину і метіоніну. У нирках утворюється гуанідінацетат при дії гліцінамідінотрансферази. Потім гуанідінацетат транспортується в печінку, де відбувається реакція його метилування.

Реакції трансметилирования використовуються також для:
- синтезу адреналіну з норадреналіну;
- синтезу анзерина з карнозина;
- метилування азотистих основ в нуклеотидах і ін .;
- інактивації метаболітів (гормонів, медіаторів і ін.) і знешкодження чужорідних сполук, включаючи і лікарські препарати.
Інактивація біогенних амінів також відбувається:
метилированием за участю SAM під дією метилтрансфераза. Таким чином можуть инактивироваться різні біогенні аміни, але частіше за все відбувається інактивація гастаміна і адреналіну. Так, інактивація адреналіну відбувається шляхом метилування гідроксильної групи в ортоположеніі

ТОКСИЧНІСТЬ АМІАКУ. ЙОГО ОСВІТА І ЗНЕШКОДЖЕННЯ.
Катаболізм амінокислот в тканинах відбувається постійно зі швидкістю ~100 г / сут. При цьому в результаті дезамінування амінокислот звільняється велика кількість аміаку. Значно менші кількості його утворюються при дезаминировании біогенних амінів і нуклеотидів. Частина аміаку утворюється в кишечнику в результаті дії бактерій на харчові білки (гниття білків в кишечнику) і надходить у кров ворітної вени. Концентрація аміаку в крові ворітної вени значно більше, ніж в загальному кровотоці. У печінці затримується велика кількість аміаку, що підтримує низький вміст його в крові. Концентрація аміаку в крові в нормі рідко перевищує 0,4-0,7 мг / л (або 25-40 мкмоль / л
Аміак - токсична сполука. Навіть невелике підвищення його концентрації справляє негативний вплив на організм, і перш за все на ЦНС. Так, підвищення концентрації аміаку в мозку до 0,6 ммоль викликає судоми. До симптомів гипераммониемии відносять тремор, нечленороздільні мова, нудоту, блювоту, запаморочення, судомні напади, втрату свідомості. У важких випадках розвивається кома з летальним результатом. Механізм токсичної дії аміаку на мозок і організм в цілому, очевидно, пов'язаний з дією його на кілька функціональних систем.
- Аміак легко проникає через мембрани до клітин і в мітохондріях зрушує реакцію, каталізується глутаматдегідрогеназа, в сторону освіти глугамата:
α-кетоглутаратом + NADH + Н + + NH 3 → Глутамат + NAD +.
Зменшення концентрації α-кетоглутарата викликає:
· Пригнічення обміну амінокислот (реакції трансу-мінування) і, отже, синтезу з них нейромедіаторів (ацетилхоліну, дофаміну і ін.);
· Гіпоенергетіческое стан в результаті зниження швидкості ЦТК.
Недостатність α-кетоглутарата призводить до зниження концентрації метаболітів ЦТК, що викликає прискорення реакції синтезу оксалоа-цетата з пірувату, що супроводжується інтенсивним споживанням СО 2. Посилене утворення і споживання діоксиду вуглецю при гіперамоніємії особливо характерні для клітин головного мозку. Підвищення концентрації аміаку в крові зрушує рН в лужну сторону (викликає алкалоз). Це, в свою чергу, збільшує спорідненість гемоглобіну до кисню, що призводить до гіпоксії тканин, накопиченню СО 2 і гіпоенергетіческое станом, від якого головним чином страждає головноймозг. Високі концентрації аміаку стимулюють синтез глутаміну з глутамату в нервовій тканині (за участю глутамінсінтетази):
Глутамат + NH 3 + АТФ → Глутамин + АДФ + Н 3 Р0 4.
· Накопичення глутаміну в клітинах нейроглії призводить до підвищення осмотичного тиску в них, набухання астроцитів і в великих концентраціях може викликати набряк мозга.Сніженіе концентрації глутамату порушує обмін амінокислот і нейромедіаторів, зокрема синтез у-аміномасляної кислоти (ГАМК), основного гальмівного медіатора. При нестачі ГАМК та інших медіаторів порушується проведення нервового імпульсу, виникають судоми. Іон NH 4 + практично не проникає через цитоплазматичні і мітохондріальні мембрани. Надлишок іона амонію в крові здатний порушувати трансмембранний перенос одновалентних катіонів Na + і К +, конкуруючи з ними за іонні канали, що також впливає на проведення нервових імпульсів.
Висока інтенсивність процесів дезамінування амінокислот в тканинах і дуже низький рівень аміаку в крові свідчать про те, що в клітинах активно відбувається зв'язування аміаку з утворенням нетоксичних сполук, які виводяться з організму з сечею. Ці реакції можна вважати реакціями знешкодження аміаку. У різних тканинах і органах виявлено кілька типів таких реакцій. Основний реакцією зв'язування аміаку, що протікає у всіх тканинах організму, є 1.) синтез глутаміну під дією глутамін-синтетази:

Глутамінсінтетаза локалізована в мітохондріях клітин, для роботи ферменту необхідний кофактор - іони Mg 2+. Глутамінсінтетаза - один з основних регуляторних ферментів обміну амінокислот і аллостеріческого відзначено зниження АМФ, глюкозо-6-фосфатом, а також Гли, Ала і Гіс.
У клітинах кишечника під дією ферменту глутамінази відбувається гидролитическое звільнення амідного азоту у вигляді аміаку:

Утворився в реакції глутамат піддається трансамінування з пируватом. ос-Аміногрупа глутамінової кислоти переноситься до складу аланина:


Глутамин - основний донор азоту в організмі. Амідний азот глутаміну використовується для синтезу пуринових і піримідинових нуклеотидів, аспарагина, аминосахаров та інших з'єднань.
МЕТОД КІЛЬКІСТЬ В ВИЗНАЧЕННЯ СЕЧОВИНИ В СИРОВАТЦІ КРОВІ
У біологічних рідинах М. визначають за допомогою газометріческіх методів, прямих фотометричних методів, заснованих на реакції М. з різними речовинами з утворенням еквімолекулярних кількостей забарвлених продуктів, а також ферментативних методів з використанням головним чином ферменту уреази. Газометріческіе методи засновані на окисленні М. гіпоброміти натрію в лужному середовищі NH 2-СО-NH 2 + 3NaBrO → N 2 + CO 2 + 3NaBr + 2H 2 O. Обсяг газоподібного азоту вимірюють за допомогою спеціального апарату, найчастіше апарату Бородіна. Однак цей метод має низьку специфічністю і точністю. З фотометричні найбільш поширені методи, засновані на реакції М. з діацетілмонооксімом (реакція Ферона).
Для визначення сечовини в сироватці крові і сечі використовують уніфікований метод, заснований на реакції М. з діацетілмонооксімом в присутності тіосемікарбазіда і солей заліза в кислому середовищі. Іншим уніфікованим методом визначення М. є уреазний метод: NH 2-СО-NH 2 → уреаза NH 3 + CO 2. Що виділився аміак утворює з гіпохлоритом натрію і фенолом індофенолу, що має синій колір. Інтенсивність забарвлення пропорційна вмісту М. в досліджуваній пробі. Уреазна реакція високоспецифічні, для дослідження беруть лише 20 мкл сироватки крові, розведеної в співвідношенні 1: 9 розчином NaCI (0,154 М). Іноді замість фенолу використовують саліцилат натрію; сироватку крові розводять у такий спосіб: до 10 мкл сироватки крові додають 0,1 млводи або NaCI (0,154 М). Ферментативна реакція в обох випадках протікає при 37 ° протягом 15 і 3-3 1/2 хввідповідно.
Похідні М., в молекулі якої атоми водню заміщені кислотними радикалами, звуться уреідов. Багато урєїди і деякі їх галогензамещенние похідні в медицині використовують в якості лікарських засобів. До уреідов відносяться, наприклад, солі барбітурової кислоти (малонілсечовина), аллоксан (мезоксалілмочевіна); гетероциклическим уреідов є Сечова кислота .
ЗАГАЛЬНА СХЕМА РАСПАДА ГЕМА. «ПРЯМИЙ» І «НЕПРЯМІ» Білірубін, КЛІНІЧНЕ ЗНАЧЕННЯ ЙОГО ВИЗНАЧЕННЯ.
Гем (гемоксигенази) -білівердін (білівердінредуктаза) -білірубін (УДФ-глюкуранілтрансфераза) -білірубінмоноглюкуронід (УД-глюкуронилтрансфераза) -білірубіндіглюкуронід

У нормальному стані концентрація загального білірубіну в плазмі становить 0,3-1 мг / дл (1,7-17 мкмоль / л), 75% від загальної кількості білірубіну знаходиться в некон'югованій формі (непрямий білірубін). У клініці кон'-югірованний білірубін називають прямим, тому що він водорастворим і може швидко взаємодіяти з діазореагентом, утворюючи з'єднання рожевого кольору, - це пряма реакція Ван дер Берга. Некон'югований білірубін гидрофобен, тому в плазмі крові міститься в комплексі з альбуміном і не реагує з диазореактивом до тих пір, поки не доданий органічний розчинник, наприклад етанол, який тримає в облозі альбумін. Некон'югований ілірубін, взаємодіє з азобарвників тільки після осадження білка, називають непрямим білірубіном.
У хворих з печінково-клітинною патологією, що супроводжується тривалим підвищенням концентрації кон'югованого білірубіну, в крові виявляють третю форму плазмового білірубіну, при якому білірубін ковалентно пов'язаний з альбуміном, і тому його неможливо відокремити звичайним способом. У деяких випадках до 90% загального вмісту білірубіну крові може знаходитися в цій формі.
МЕТОДИ ВИЯВЛЕННЯ ГЕМА ГЕМОГЛОБІНУ: Фізичний (СПЕКТРАЛЬНИЙ АНАЛІЗ ГЕМОГЛОБІНУ І ЙОГО ПОХІДНИХ); ФІЗИКО-ХІМІЧНИЙ (ОТРИМАННЯ КРИСТАЛІВ солянокислих Геміні).
Спектральний аналіз гемоглобіну і його похідних. Використання спектрографічних методів при розгляді розчину оксигемоглобіну виявляє в жовто-зеленій частині спектра між Фраунгоферовського лініями D і Е дві системні смуги поглинання, у відновленого гемоглобіну в тій же частині спектра є лише одна широка смуга. Відмінності в поглинанні випромінювання гемоглобіном і оксигемоглобіном послужили основою для методу вивчення ступеня насичення крові киснем - оксігемометріі.
Карбгемоглобін за своїм спектру близький до оксигемоглобіном, однак при додаванні відновлює речовини у карбгемоглобина з'являються дві смуги поглинання. Спектр метгемоглобіну характеризується однією вузькою смугою поглинання зліва на кордоні червоної і жовтої частини спектра, другий вузькою смугою на кордоні жовтої і зеленої зон, нарешті, третій широкою смугою в зеленій частині спектра
Кристали геміну або солянокислого гема-тину. З поверхні плями зіскоблюється на предметне скло і подрібнюється кілька крупинок. До них додаються 1-2 крупинки кухонної солі і 2-3 краплі крижаної уксус- ної к-ти. Все накривають покривним склом і обережно, не доводячи до кипіння, нагрівають. Присутність крові доводиться появою мікрокристалів буро-жовтого кольору у вигляді ромбічних табличок. Якщо кристали погано сформовані, то мають вигляд конопляного насіння. Отримання кристалів геміну безумовно доводить присутність в досліджуваному об'єкті крові. Негативний результат проби не має значення. Домішка жиру, іржа ускладнюють отримання кристалів геміну
АКТИВНІ ФОРМИ КИСНЮ: супероксид АНІОН, ПЕРОКСИД водню, гідроксильні РАДИКАЛ, пероксинітрит. ЇХ ОСВІТА, ПРИЧИНИ ТОКСИЧНОСТІ. ФІЗІОЛОГІЧНА РОЛЬ АФК.
В ЦПЕ поглинається близько 90% надходить в клітини О2. Інша частина О2 використовується в інших ОВР. Ферменти, що беруть участь ОВР з використанням О2, діляться на 2 групи: оксидази і оксигенази.
Оксидази використовують молекулярний кисень тільки в якості акцептора електронів, відновлюючи його до Н 2 О або Н 2 О 2.
Оксигенази включають один (монооксигенази) або два (діоксигенази) атома кисню в утворюється продукт реакції.
Хоча ці реакції не супроводжуються синтезом АТФ, вони необхідні для багатьох специфічних реакцій в обміні амінокислот), синтезі жовчних кислот і стероїдів), в реакціях знешкодження чужорідних речовин в печінці
У більшості реакцій за участю молекулярного кисню його відновлення відбувається поетапно з перенесенням одного електрона на кожному етапі. При одноелектронному перенесення відбувається утворення проміжних високореактивних форм кисню.
У збудженому стані кисень нетоксичний. Освіта токсичних форм кисню пов'язано з особливостями його молекулярної структури. О 2 містить 2 неспарених електрона, які розташовуються на різних орбіталях. Кожна з цих орбіталей може прийняти ще один електрон.
Повне відновлення О2 відбувається в результаті 4 одноелектронних переходів:
Супероксид, пероксид і гідроксильний радикал - активні окислювачі, що представляє серйозну небезпеку для багатьох структурних компонентів клітини
Активні форми кисню можуть отщеплять електрони від багатьох з'єднань, перетворюючи їх в нові вільні радикали, ініціюючи ланцюгові окислювальні реакції
Шкідлива дія вільних радикалів на компоненти клітини. 1 - руйнування білків; 2 - пошкодження ЕР; 3 - руйнування ядерної мембрани і пошкодження ДНК; 4 - руйнування мембран мітохондрій; проникнення в клітину води і іонів.
Освіта супероксида в ЦПЕ. "Витік" електронів в ЦПЕ може відбуватися при перенесенні електронів за участю коензиму Q. При відновленні убихинон перетворюється на аніон-радикал семіхінонов. Цей радикал нефермента-тивно взаємодіє з О2 з утворенням супероксидного радикала. 
Велика частина активних форм кисню утворюється при перенесенні електронів в ЦПЕ, перш за все, при функціонуванні QH 2 -дегідрогеназного комплексу. Це відбувається в результаті неферментативного перенесення ( "витоку") електронів з QH 2 на кисень (
на етапі перенесення електронів за участю цитохромоксидази (комплекс IV) "витік" електронів не відбувається завдяки наявності в ферменті спеціальних активних центрів, що містять Fe і Сu і відновлюють О2 без звільнення проміжних вільних радикалів.
У фагоцитирующих лейкоцитах в процесі фагоцитозу посилюються поглинання кисню і утворення активних радикалів. Активні форми кисню утворюються в результаті активації NADPH-оксидази, переважно локалізованої на зовнішній стороні плазматичної мембрани, ініціюючи так званий "респіраторний вибух" з утворенням активних форм кисню
Захист організму від токсичної дії активних форм кисню пов'язана з наявністю у всіх клітинах високоспецифічних ферментів: супероксиддисмутази, каталази, глутатіон-пероксидази, а також з дією антиоксидантів.
ЗНЕШКОДЖЕННЯ АКТИВНИХ ФОРМ КИСНЮ. Ферментні АНТИОКСИДАНТНА СИСТЕМА (каталази, супероксиддисмутази, глутатіонпероксидази, глутатіонредуктази). СХЕМИ ПРОЦЕСІВ, БІОРОЛЬ, МІСЦЕ ПЕРЕБІГУ.
Супероксиддисмутаза каталізує реакцію дисмутації супероксидних аніон - радикалів:
О2.- + О2.- \u003d О2 + Н 2О2
В ході реакції утворився пероксид водню, він здатний інактивувати СОД, тому супероксиддисмутаза завжди «працює» в парі скаталазой, яка швидко і ефективно розщеплює пероксид водню на абсолютно нейтральні з'єднання.
каталаза (КФ 1.11.1.6) - гемопротеинов, який каталізує реакцію знешкодження пероксиду водню, що утворюється в результаті реакції дисмутації супероксидного радикала:
2H2O2 \u003d 2H2O + O2
Глутатіонпероксідазакаталізірует реакції, в яких фермент відновлює пероксид водню до води, а також відновлення органічних гідропероксидів (ROOH) до гідроксипохідних, і в результаті переходить в окислених дисульфидную форму GS-SG:
2GSH + H2O2 \u003d GS-SG + H2O
2GSH + ROOH \u003d GS-SG + ROH + H2O
глутатионпероксидаза знешкоджує не тільки H2O2, але і різні органічні ліпідні пероксіли, які утворюються в організмі при активації ПОЛ.
глутатіонредуктаза (КФ 1.8.1.7) - флавопротеїнів з простетичної групою флавінаденіндінуклеотіда, складається з двох ідентичних субодиниць. глутатіонредуктаза каталізує реакцію відновлення глутатіону з окисленої його форми GS-SG, а всі інші ферменти глутатіонсінтетази використовують його:
2NADPH + GS-SG \u003d 2NADP + 2 GSH
Це класичний цитозольний фермент всіх еукаріот.Глутатіонтрансфераза каталізує реакцію:
RX + GSH \u003d HX + GS-SG
ФАЗА кон'югації в системі знешкодження ТОКСИЧНИХ РЕЧОВИН. ВИДИ кон'югації (Приклади РЕАКЦИЙ З ФАФС, УДФГК)
Кон'югація - друга фаза знешкодження речовин, в ході якої відбувається приєднання до функціональних групах, що утворюється на першому етапі, інших молекул або груп ендогенного походження, що збільшують гідрофільність і зменшують токсичність ксенобіотиків
1. Участь трансфераз в реакціях кон'югації
УДФ-глюкуронілтрансферази. Локалізовані в основному в ЕР уридин-дифосфат (УДФ) -глюкуронілтрансферази приєднують залишок глюкуронової кислоти до молекули речовини, утвореного в ході мік-росомального окислення
У загальному вигляді: ROH + УДФ-С6Н9О6 \u003d RO-C6H9O6 + УДФ.
Сульфотрансферази. Цитоплазматичні cульфотрансферази каталізують реакцію кон'югації, в ході якої залишок сірчаної кислоти (-SO3H) від 3 "-фосфоаденозін-5" -фосфосульфата (ФАФС) приєднується до фенолу, спиртів або амінокислотам
Реакція в загальному вигляді: ROH + ФАФ-SO3H \u003d RO-SO3H + ФАФ.
Ферменти сульфотрансферази і УДФ-глюкуронілтрансферази беруть участь у знешкодженні ксенобіотиків, інактивації ліків і ендогенних біологічно активних сполук.
Глутатіонтрансферази. Особливе місце серед ферментів, які беруть участь у знешкодженні ксенобіотиків, інактивації нормальних метаболітів, ліків, займають глутатіонтрансферази (ГТ). Глутатіонтрансферази функціонують у всіх тканинах і грають важливу роль в інактивації власних метаболітів: деяких стероїдних гормонів, білірубіну, жовчних кислот, В клітці ГТ в основному локалізовані в цитоплазмі, але є варіанти ферментів в ядрі і мітохондріях.
Глутатіон - трипептид Гли-Цис-Гли (залишок глутамінової кислоти приєднаний до цис-теїн карбоксильною групою радикала). ГТ мають широку специфічністю до субстратів, загальна кількість яких перевищує 3000. ГТ пов'язують дуже багато гідрофобні речовини і інактивують їх, але хімічної модифікації з участю глугатіона піддаються тільки ті, які мають полярну групу. Тобто субстратами служать речовини, які, з одного боку, мають електрофільні центр (наприклад, ОН-групу), а з іншого боку - гідрофобні зони. Знешкодження, тобто хімічна модифікація ксенобіотиків за участю ГТ, може здійснюватися трьома різними способами:
шляхом кон'югації субстрату R з глутатионом (GSH): R + GSH → GSRH,
в результаті нуклеофільного заміщення: RX + GSH → GSR + НХ,
відновлення органічних пероксидів до спиртів: R-HC-O-OH + 2 GSH → R-HC-OH + GSSG + H2O
У реакції: ООН - гідропероксідная група, GSSG - окислений глутатіон.
Сісгеми знешкодження за участю ГТ і глутатіону відіграє унікальну роль у формуванні резистентності організму до різних впливів і є найбільш важливим захисним механізмом клітини. В ході біотрансформації деяких ксенобіотиків під дією ГТ утворюються тіоефіри (кон'югати RSG), які потім перетворюються в меркаптани, серед яких виявлені токсичні продукти. Але кон'югати GSH з більшістю ксенобіотиків менш реакційно-здатні і більш гідрофільних, ніж вихідні речовини, а тому менш токсичні і легше виводяться з організму
ГТ своїми гідрофобними центрами можуть не-ковалентно пов'язувати величезна кількість ли-пофільная з'єднань (фізичне знешкодження), запобігаючи їх впровадження в ліпідний шар мембран і порушення функцій клітини. Тому ГТ іноді називають внутрішньоклітинним альбуміном.
ГТ можуть ковалентно пов'язувати ксенобіотики, які є сильними електролітами. Приєднання таких речовин - "самогубство" для ГТ, але додатковий захисний механізм для клітини.
Ацетилтрансферази, метилтрансферази
Ацетилтрансферази каталізують реакції кон'югації - перенесення ацетильную залишку від ацетил-КоА на азот групи -SO2NH2, наприклад в складі сульфаніламідів. Мембранні і цитоплазматичні метилтрансферази за участю SAM метіліруют групи Р \u003d О, -NH2 і SH-групи ксенобіотиків.
Роль епоксідгідролаз в освіті діолів
У другій фазі знешкодження (реакції кон'югації) беруть участь і деякі інші ферменти. Епоксідгідролаза (епоксідгідратаза) приєднує воду до Епоксид бензолу, бензопірену та інших поліциклічних вуглеводнів, утвореним в ході першої фази знешкодження, і перетворює їх в діоли (рис. 12-8). Епоксиди, що утворилися при мікросомального окислення, є канцерогенами. Вони мають високу хімічну активність і можуть брати участь в реакціях неферментативного алкилирования ДНК, РНК, білків Хімічні модифікації цих молекул можуть привести до переродження нормальної клітини в пухлинну.
РОЛЬ БІЛКІВ У ХАРЧУВАННЯ, НОРМИ, баланс азоту, КОЕФІЦІЄНТ зношування, ФІЗІОЛОГІЧНИЙ БІЛКОВИЙ МІНІМУМ. БІЛКОВА недостатність.
АК містять майже 95% всього азоту, тому саме вони підтримують азотистий баланс організму. баланс азоту - різниця між кількістю азоту, що надходить з їжею, і кількістю виділяється азоту. Якщо кількість що надходить азоту дорівнює кількості виділяється, то настає азотисте рівновагу. Такий стан буває у здорової людини при нормальному харчуванні. Баланс азоту може бути позитивним (азоту надходить більше, ніж виводиться) у дітей, у пацієнтів. Негативний азотистий баланс (виділення азоту переважає над його надходженням) спостерігають при старінні, голодуванні і під час важких захворювань. При без білковій дієті азотистий баланс стає негативним. Мінімальна кількість білків в їжі, необхідне для підтримки азотистого рівноваги, відповідає 30-50 г / cyt, оптимальне ж кількість при середньому фізичному навантаженні становить ~100-120 г / сут.
амінокислоти, синтез яких складний і неекономічний для організму, очевидно, вигідніше отримувати з їжею. Такі амінокислоти називають незамінними. До них відносять фенілаланін, метіонін, треонін, триптофан, валін, лізин, лейцин, ізолейцин.
Дві амінокислоти - аргінін і гістидин називають частково замінними. - тирозин і цистеїн - умовно замінні, так як для їх синтезу необхідні незамінні амінокислоти. Тирозин синтезується з фенілаланіну, а для освіти цистеїну необхідний атом сірки метіоніну.
Решта амінокислоти легко синтезуються в клітинах і називаються замінними. До них відносять гліцин, аспарагінову кислоту, аспарагін, глутамінової кислоти, глутамін, серії, про
Зміст теми "Обмін речовин і енергії. Харчування. Основний обмін.":1. Обмін речовин і енергії. Живлення. Анаболизм. Катаболізм.
2. Білки і їх роль в організмі. Коефіцієнт зношування по Рубнер. Позитивний баланс азоту. Негативний азотистий баланс.
3. Ліпіди і їх роль в організмі. Жири. Клітинні ліпіди. Фосфоліпіди. Холестерин.
4. Бурий жир. Бура жирова тканина. Ліпіди плазми крові. Ліпопротеїни. ЛПНЩ. ЛПВЩ. ЛПДНЩ.
5. Вуглеводи і їх роль в організмі. Глюкоза. Глікоген.
8. Роль обміну речовин в забезпеченні енергетичних потреб організму. Коефіцієнт фосфорилювання. Теплотворний еквівалент кисню.
9. Способи оцінки енергетичних витрат організму. Пряма калориметрія. Непряма калориметрія.
10. Основний обмін. Рівняння для розрахунку величини основного обміну. Закон поверхні тіла.
Білки і їх роль в організмі. Коефіцієнт зношування по Рубнер. Позитивний баланс азоту. Негативний азотистий баланс.
Роль білків, жирів, вуглеводів, мінеральних речовин і вітамінів у метаболізмі
Потреба організму в пластичних речовинах може бути задоволена тим мінімальним рівнем їх надходження з їжею, який врівноважує втрати структурних білків, ліпідів і вуглеводів. Ці потреби індивідуальні і залежать від таких факторів, як вік людини, стан здоров'я, інтенсивність і вид праці.
Людина отримує в складі харчових продуктів укладені в них пластичні речовини, Мінеральні речовини і вітаміни.
Білки і їх роль в організмі
Білки в організмі знаходяться в стані безперервного обміну та оновлення. У здорової дорослої людини кількість розпався за добу білка дорівнює кількості знову синтезованого. Тварини істоти можуть засвоювати азот тільки в складі амінокислот, що надходять в організм з білками їжі. Десять амінокислот з 20 (валін, лейцин, ізолейцин, лізин, метіонін, триптофан, треонін, фенілаланін, аргінін і гістидин) в разі їх недостатнього надходження з їжею не можуть бути синтезовані в організмі. Ці амінокислоти називають незамінними. Інші десять амінокислот (замінні) не менш важливі для життєдіяльності, ніж незамінні, але в разі недостатнього надходження з їжею замінних амінокислот вони можуть синтезуватися в організмі. Важливим фактором обміну білків організму є повторне використання (реутилізацію) амінокислот, що утворилися при розпаді одних білкових молекул, для синтезу інших.
Швидкість розпаду і відновлення білків організму різна. Напівперіод розпаду гормонів пептидної природи становить хвилини або години, білків плазми крові і печінки -близько 10 діб, білків м'язів - близько 180 діб. В середньому всі білки організму людини оновлюються за 80 діб. Про сумарній кількості білка, що піддалося розпаду за добу, судять за кількістю азоту, виведеного з організму людини. У білку міститься близько 16% азоту (т. Е. В 100 г білка 16 г азоту). Таким чином, виділення організмом 1 г азоту відповідає розпаду 6,25 г білка. За добу з організму дорослої людини виділяється близько 3,7 г азоту. З цих даних випливає, що маса білка, що піддалося за добу повного руйнування, становить 3,7 х 6,25 \u003d 23 г, або 0,028-0,075 г азоту на 1 кг маси тіла на добу ( коефіцієнт зношування по Рубнер).

Якщо кількість азоту, що надходить в організм з їжею, дорівнює кількості азоту, що виводиться з організму, прийнято вважати, що організм перебуває в стані азотистого рівноваги. У випадках, коли в організм надходить азоту більше, ніж його виділяється, говорять про позитивному азотистом балансі (Затримки, ретенції азоту). Такі стани бувають у людини при збільшенні маси м'язової тканини, в період росту організму, вагітності, одужання після важкого виснажливого захворювання.
Стан, при якому кількість виведеного з організму азоту перевищує його надходження в організм, називають негативний баланс азоту. Воно має місце при харчуванні неповноцінними білками, коли в організм не надходять якісь із незамінних амінокислот, При білковому голодуванні або при повному голодуванні.
білки, Що використовуються в організмі в першу чергу в якості пластичних речовин, в процесі їх руйнування звільняють енергію для синтезу в клітинах АТФ і освіти тепла.
Білки харчових продуктів є основним джерелом азоту для організму. Азот виводиться з організму у вигляді кінцевих продуктів азотистого обміну. Стан азотистого обміну характеризується поняттям азотистий баланс.
баланс азоту - різниця між вступником в організм і виводиться з організму азотом. Розрізняють три види азотистого балансу: азотисті рівновагу, позитивний баланс азоту, негативний баланс азоту
при позитивному азотистом балансі надходження азоту переважає над його виділенням. У фізіологічних умовах зустрічається істинний позитивний баланс азоту (вагітність, лактація, дитячий вік). Для дітей у віці 1 року життя він становить + 30%, в 4 роки - + 25%, в підлітковому віці + 14%. При захворюванні нирок можливий помилковий позитивний баланс азоту, при якому відбувається затримка в організмі кінцевих продуктів азотистого обміну.
при негативному азотистом балансі переважає виділення азоту над його надходженням. Цей стан можливий при таких захворюваннях як туберкульоз, ревматизм, онкологічні захворювання. азотиста рівновага характерно для здорових дорослих людей, у яких надходження азоту дорівнювала його виділенню.
Азотистий обмін характеризується коефіцієнтом зношування,під яким розуміють ту кількість білка, яке втрачається з організму в умовах повного білкового голодування. Для дорослої людини він становить 53 мг / кг (або 24 г / добу). У новонароджених коефіцієнт зношування вище і становить 120 мг / кг. Азотиста рівновага забезпечується білковим харчуванням.
білковий раціон характеризується опредёленнимі кількісними і якісними критеріями.
Кількісні критерії білкового харчування
білковий мінімум - то кількість білка, яке забезпечує азотисте рівновагу за умови, що всі енергетичні витрати забезпечуються вуглеводами і жирами. Він становить 40-45 г / добу. При тривалому використанні білкового мінімуму страждають імунні процеси, процеси кровотворення, репродуктивна система. Тому для дорослих людей необхідний білковий оптимум - то кількість білка, яке забезпечує виконання всіх його функцій без шкоди для здоров'я. Він становить 100 - 120 г / добу.
Для дітей норма споживання в даний час переглядається у бік її зниження. Для новонародженого потреба в білках становить близько 2 г / кг, до кінця 1 року знижується при природному вигодовуванні до 1 г / добу, при штучному вигодовуванні залишається в межах 1,5 - 2 г / добу
Якісні критерії білкового харчування
Більш цінні для організму білки повинні відповідати наступним вимогам:
- містити набір усіх незамінних амінокислот (валін, лейцин, ізолейцин, треонін, метіонін, лізин, аргінін, гістидин, триптофан, фенілаланін).
- співвідношення між амінокислотами має бути близьким до співвідношення їх в тканинних білках
- добре перетравлюватися в шлунково-кишковому тракті
Цим вимогам в більшій мірі відповідають білки тваринного походження. Для новонароджених все білки повинні бути повноцінними (білки грудного молока). У віці 3-4 роки близько 70-75% повинно припадати на повноцінні білки. Для дорослих людей їх частка повинна складати близько 50%.
Білки є незамінним компонентом їжі. На відміну від білків - вуглеводи і жири не є незамінними компонентами їжі. Щодоби споживається близько 100 грамів білків дорослим здоровою людиною. Харчові білки - це головне джерело азоту для організму. У сенсі економічному білки є найдорожчим харчовим компонентом. Тому дуже важливим в історії біохімії та медицини було встановлення норм білка в харчуванні.
У дослідах Карла Фойта вперше були встановлені норми споживання харчового білка - 118г / добу, вуглеводів - 500г / добу, жирів 56г / добу. М.Рубнер першим визначив, що 75% азоту в організмі знаходиться в складі білків. Він склав баланс азоту (визначив, скільки азоту людина втрачає за добу і скільки азоту додається).
У дорослої здорової людини спостерігається азотисте рівновагу - «нульовий баланс азоту»(Добова кількість виведеного з організму азоту відповідає кількості засвоєного).
Позитивний баланс азоту (Добова кількість виведеного з організму азоту менше, ніж кількість засвоєного). Спостерігається тільки в зростаючому організмі або при відновленні білкових структур (наприклад, в періоді одужання при важких захворюваннях або при нарощуванні м'язової маси).
Негативний азотистий баланс (Добова кількість виведеного з організму азоту вище, ніж кількість засвоєного). Спостерігається при білкової недостатності в організмі. Причини: недостатня кількість білків в їжі; захворювання, що супроводжуються підвищеним руйнуванням білків.
В історії біохімії проводилися експерименти, коли людину годували тільки вуглеводами і жирами ( «безбелковая дієта»). У цих умовах вимірювали азотистий баланс. Через кілька днів виведення азоту з організму зменшувалася до певного значення, і після цього підтримувалося тривалий час на постійному рівні: людина втрачала щодоби 53 мг азоту на кг ваги на добу (приблизно 4 г азоту на добу). Це кількість азоту відповідає приблизно 23-25г білка в добу. Цю величину назвали "КОЕФІЦІЄНТ зношування". Потім щодня додавали в раціон 10г білка, і виведення азоту при цьому підвищувався. Але все одно спостерігався негативний баланс азоту. Тоді в їжу стали додавати 40-45-50 грамів білка в добу. При такому вмісті білка в їжі спостерігався нульовий баланс азоту (азотна рівновага). цю величину (40-50 грамів білка в добу) назвали ФІЗІОЛОГІЧНИЙ МІНІМУМ БЕЛКА.
У 1951 році були запропоновані норми білка в харчуванні: 110-120 грамів білка в добу.
В даний час встановлено, що 8 амінокислот є незамінними. Добова потреба в кожної незамінної амінокислоти - 1-1.5 гр., А всього організму необхідно 6-9 грамів незамінних амінокислот на добу. Вміст незамінних амінокислот в різних харчових продуктах розрізняється. Позтому фізіологічний мінімум білка може бути різним для різних продуктів.
Скільки необхідно з'їдати білка для підтримки азотистого рівноваги? 20 гр. яєчного білка, або 26-27 гр. білків м'яса або молока, або 30 гр. білків картоплі, або 67 гр. білків пшеничного борошна. У яєчному білку міститься повний набір амінокислот. При харчуванні рослинними білками необхідно набагато більше білка для заповнення фізіологічного мінімуму. Потреби в білку у жінок (58 грамів на добу) менше, ніж у чоловіків (70 г білка в добу) - дані нормативів США.